近日,符雷蕾副教授研究小组在药物化学领域权威期刊EuropeanJournal of Medicinal Chemistry(影响因子7.088)上发表综述《Targeting VPS34 in autophagy: An update on pharmacological smallmolecule compounds》。js33333金沙线路检测为唯一署名单位,符雷蕾副教授为本文的独立通讯作者,硕士研究生刘媛为文章第一作者,杨齐林为第二作者,陈思伟和李自祥也参与了部分工作。

细胞自噬作为一个主要的细胞内降解系统,与人类的各种病理生理过程密切相关。在正常的生理条件下,细胞自噬有利于细胞保持自我稳定状态;在应激情况下,细胞自噬可以防止有毒或致癌的受损蛋白质和细胞器的积累,抑制细胞癌变;但一旦形成肿瘤,细胞自噬又为癌细胞提供更丰富的营养,促进肿瘤生长。因此,在肿瘤的发展过程中,细胞自噬的作用呈现出两面性。氯喹(CQ)和羟氯喹(HCQ)是公认的自噬下游抑制剂,已进入临床试验阶段;然而也有报道称,在较高剂量的羟氯喹中出现了耐药性和因视网膜毒性而导致的不可逆的视力丧。因此,研究人员已将注意力转向自噬的上游,寻找新型自噬抑制剂。VPS34是自噬启动形成过程中的一个重要的蛋白激酶,因此受到广泛关注。
众所周知,VPS34是第三类磷脂酰肌醇3-激酶(PI3K)家族的独特成员,形成VPS34复合物1和复合物2,参与几个关键生理过程。值得注意的是,VPS34复合物1是自噬体生成的一个重要节点,它通过自噬途径控制T细胞的代谢并维持细胞的平衡。此外,VPS34复合体2参与内吞作用以及囊泡运输,并与神经传递、抗原呈现和大脑发育密切相关。由于VPS34的这两个重要的生物学功能,它的失调可以通过改变人类的正常生理结构而导致心血管疾病、癌症、神经系统疾病和许多类型的人类疾病的发生。
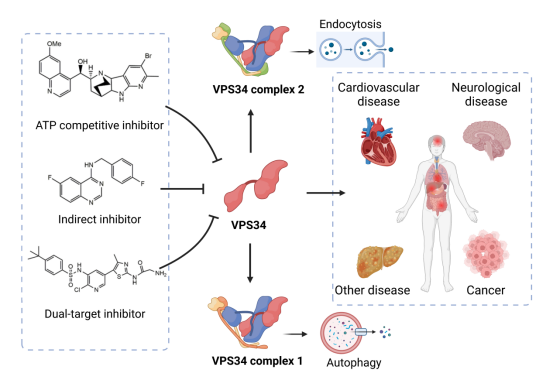
鉴于VPS34在生物体内的重要作用,针对VPS34的小分子化合物的研究越来越多地被研究。近日,js33333金沙线路检测符雷蕾研究小组就VPS34的结构特征、靶向VPS34的ATP竞争性抑制剂、间接抑制剂和双靶点抑制剂,并从体内外活性、选择性、构效关系等角度进行阐述。基于VPS34 ATP活性位点的结构差异进行抑制剂的筛选和合成仍然是目前VPS34抑制剂研究的主要方向。而且应更加关注双靶点抑制剂和药物组合的研究,以使药物发挥更好的作用。随着更强大的筛选技术的出现和人工智能方法的帮助,VPS34抑制剂的发现将变得比传统方法更有效,并在未来为治疗VPS34相关疾病带来新的希望。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S0223523423004336
